化学发光免疫分析中羧基与Tosyl磁珠包被抗体方法及注意事项
浏览人数:677 发布时间:2023-04-05 22:02
化学发光免疫分析(chemiluminescence immunoassay,CLIA),是具有高灵敏度的化学发光测定技术与高特异性的免疫反应相结合,通过抗原抗体的免疫反应检测各项标志物的免疫分析技术。该技术广泛用于传染病,心脏疾病,肿瘤,妊娠检测等领域。是现阶段体外诊断领域最主流的技术和趋势。磁性微粒(磁珠)是化学发光免疫分析中的一种重要原料。常用磁珠主要是粒径1-3um,修饰了羧基、甲苯磺酰基或者链霉亲和素的免疫磁珠。今天小编就以JSR磁珠为例,为大家介绍一下羧基和甲苯磺酰基磁珠相关的抗体包被的方法以及影响因素。
※ 羧基磁珠反应原理
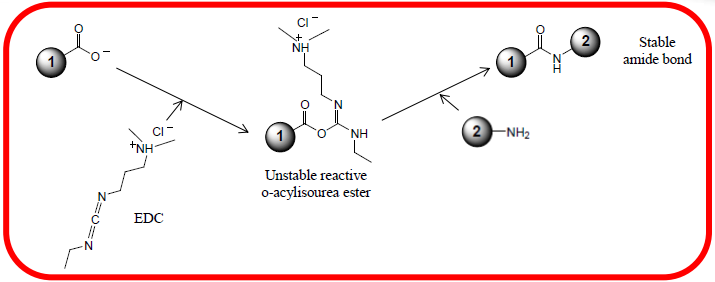
羧基和EDC反应活化,形成中间体,中间体和抗体的氨基反应,将抗体连接在磁珠表面。
※ Tosyl磁珠反应原理
抗体根据自身的疏水性逐渐和疏水的Tosyl基团靠近,达到合适距离后,抗体所携带的氨基和Tosyl基团发生自然反应,将抗体连接在磁珠表面。
※ 包被条件对比
1步法中影响发光值的因素:
① Buffer的PH值:1步法对PH值非常敏感。PH值不合适会出现聚集、包被效率低等问题。
1步法中包被效率比较高的PH条件为4-6.5,考虑到抗体的稳定性,一般在5-7条件下进行包被
在下面的A、B、C三个不同的项目中,用控制变量法对PH值进行讨论。
A项目
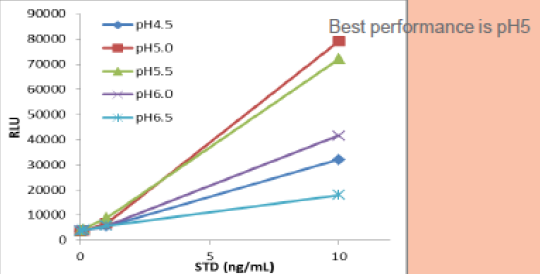
B项目
可以看出:A、B项目均在PH5时发光值最高。A项目中PH6的发光值接近PH5;而B项目中PH6条件对比PH5,发光值减半;C项目中PH6时发光值最高,而仅仅改变了0.5的PH5.5条件下的发光值已经减半
不同项目对PH值的敏感度不同,最适条件也不同,需要做梯度探讨。
②EDC用量:1步法对EDC的用量也是非常敏感的。EDC过少会影响发光值,过多也可能会造成抗体团聚、失活、发光值下降等问题。
羧基和氨基反应分为前后两个步骤,羧基活化在偏酸性条件下,效率更高。活化中间体和氨基的反应在偏碱性条件下效率更高。所以在羧基活化和抗体包被的步骤可以通过置换Buffer来调整PH值。
影响发光值的其他条件:
o Buffer的离子浓度,浓度过高容易产生团聚现象
o 封闭剂用量和封闭时间,封闭剂用量少或时间不足,容易产生本底高等问题
o 抗体用量等
两种方法的对比:
D项目中通过调整PH值可以看到1步法还是2步法对发光值影响不明显。
E项目中即使将PH值调整到最佳状态,1步法的发光值也不如2步法。
虽然大部分项目都可以用1步法,但并非所有项目都适用,包被过程用1步法还是2步法需要进一步进行对比试验。
在Tosyl磁珠和抗体结合的过程中,影响因素主要有硫酸铵用量,PH值,温度,反应时间和封闭过程等。
①硫酸铵:硫酸铵的添加是为了提高抗体的疏水性,以便抗体可以和Tosyl基团更好的接近。而过多的硫酸铵会造成抗体的变性,所以对于不同的项目加入多少硫酸铵的量需要单独地去衡量。
②PH值:Tosyl基团和氨基的反应需要在中性偏碱的条件下进行。
③温度和反应时间:Tosyl磁珠包被抗体需要在37℃高温条件下长时间反应,推荐的反应时间为18-24 小时。如果是对温度比较敏感的抗体,可以在室温条件反应,需要适当延长反应时间。使用Tosyl磁珠需要抗体可以在高温环境中长时间反应而不变性。在下图37℃和4℃条件反应的对比中,可以看出在4℃条件反应24小时,也不如在37℃反应1小时的反应度。
④封闭过程:由于Tosyl基团本身是疏水性的,如果封闭不充分,Tosyl基团会对血清中的其他组分产生非特异性吸附,造成假阳性等问题。在项目开发初期,研发老师都会面临磁珠选择的问题,可以根据公司或研发者的使用习惯去选择。大部分常规项目,羧基磁珠和Tosyl磁珠都是可以包被成功的。
在实际生产中,羧基磁珠使用过程工艺复杂,关键控制点多,包被过程中需要EDC的活化,活化情况的好坏会影响试剂的均一性。
Tosyl磁珠的特点则相反:用时长但工艺简单,生产易控制,使用中可以避免活化步骤对试剂性能的影响。但是Tosyl磁珠也有一些局限:①易产生非特异性吸附,影响本底。②反应条件相对苛刻,使用的抗体需要能在高温和碱性环境下长时间反应。